CEFALEE, COMORBIDITA’ E SINDROME DOLOROSE “SINE MATERIA”:
LE CENTRAL SENSITIVITY SYNDROMES.
HEADACHE, COMORBITIES AND “SINE MATERIA” PAIN SYNDROMES:
THE CENTRAL SENSITIVITY SYNDROMES
G. Calagna, Resp. Ambulatorio Cefalee ASP Palermo P.O. “Civico” Partinico (Pa)
via Circonvallazione 2 90047 Partinico (Pa)
giuseppecalagna@tin.it
Introduzione
Nell’ambito del mare magnum delle comorbidità che gravano sull’universo delle cefalee, le Central Sensitivity Syndromes (CSS) (Sindromi da Sensibilizzazione Centrale) rappresentano negli ultimi anni una nuova frontiera in tema di comprensione della fisiopatologia del dolore cronico e di molti disturbi “sine materia” di origine pluridisciplinare. Trattasi di un gruppo corposo (13 sindromi secondo un lavoro di Yunus del 2008), fra i quali sono presenti fibromialgia, emicrania e cefalea tensiva. Denominatore comune di questi disturbi sarebbe l’evidenza di Sensibilizzazione Centrale (“central sensitization” o CS ). I criteri nosografici in questo campo risentono ancora in maniera nefasta del dualismo mente-corpo di cartesiana memoria, che ha contribuito alla creazione di una sorta di “terra di nessuno” costituita da un corposo gruppo di disturbi di origine pluridisciplinare che in quanto riconosciuti privi di patologia strutturale (sine materia) sono stati affrettatamente considerati tout court psicosomatici. Le CSS non rappresentano né sostituiscono i disturbi somatoformi ma rappresentano una visione più olistica della realtà di queste patologie, nell’ottica di un superamento del dualismo mente-corpo.
Lo spettro delle Central Sensitivity Syndromes
Il primo rilievo di un importante associazione fra fibromialgia (FMS), emicrania, cefalea tensiva e sindrome del colon irritabile (IBS) risale al 1981 (Yunus et al). Dapprima tali disturbi vengono definiti "sindromi da stress", dopo “disturbi dello spettro affettivo” (Hudson et al., 1989) e ancora "sindromi dello spettro disfunzionale", ma seppur appare evidente che eventi stressanti, disturbi dell’umore e /o d’ansia e disfunzioni neuroendocrine giocano un ruolo importante nell’esplicamento clinico delle CSS , di certo tali fattori non rappresentano il meccanismo fisiopatogenetico comune prevalente. Infine nel 2000 Yunus conia il termine CSS sulla base di evidenze sperimentali di CS nella FMS e negli altri disturbi associati, ipotizzando che questo meccanismo possa esserne il legante fisiopatologico prevalente.
In seguito le evidenze divengono più crescenti, tanto che in un lavoro del 2007 Yunus presenta un gruppo di ben 13 sindromi (vedi fig.1). Oltre alle 4 precedenti vengono aggiunte: i Disturbi Temporo-Mandibolari, la Sindrome da Fatica Cronica, la Cistite Interstiziale/S. Uretrale femminile; la Sensibilità Chimica Multipla; il Disturbo Post-traumatico da Stress; la S. Miofasciale/S. Dolorosa Regionale dei Tessuti Molli, la S. delle Gambe Senza Riposo, la Dismenorrea Primaria, i Movimenti Periodici degli Arti nel Sonno. Inoltre vi sono altre condizioni che attendono nuove conferme per far parte dello spettro CSS, come la Sindrome Tensiva Perimestruale e la Vulvodinia. La cosiddetta Sindrome della Guerra del Golfo (GWS) invece sembra per lo più un mix di altre condizioni, quali FMS, s. da fatica cronica, s. da sensibilità chimica multipla, PTDS e IBS. Un altro gruppo di lavoro (Kindler et al. 2009) definisce come CSS anche il Low Back Pain (dolore lombare cronico) e il Dolore Cervicale Cronico (che comprende anche il cosiddetto dolore da colpo di frusta cronico).
....................................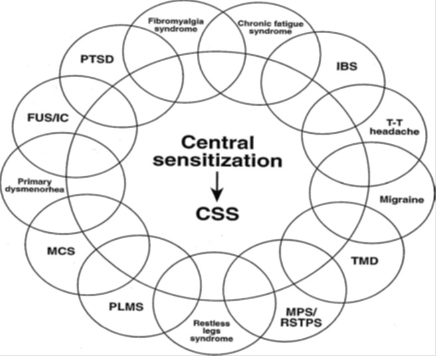
Fig.1: Proposta corrente di membri del gruppo CSS:
IBS (s. colon irritabile); T-T headache (cefalea tensiva); TMD (d. temporo-mandibolari); MPS (s. dolorosa mio fasciale)/;RSTPS (s. dolorosa regionale dei tessuti molli; PLMS (movimenti periodici degli arti nel sonno); MCS (sensibilità chimica multipla); FUS (s. uretrale femminile)/IC (cistite interstiziale); PTDS (d. post-traumatico da stress); Restless legs syndrome (s. delle gambe senza riposo).
Secondo Yunus i criteri essenziali per riconoscere una CSS sono: 1) una relazione di mutua associazione fra i vari membri; 2) un meccanismo fisiopatologico comune: la dimostrazione di CS a vari stimoli. Un terzo criterio sarebbe la natura sostanzialmente “sine materia” del dolore e degli altri sintomi, cioè “privi di patologia strutturale sottostante”, anche se la questione della “funzionalità” dei disturbi è piuttosto dubbia, in quanto è stato dimostrato che questi disturbi presentano evidenze di anomalie ormonali ed immunologiche.
Le CSS generalmente presentano una serie di sintomi comuni, quali dolore, facile faticabilità, sonno disturbato, ipersensibilità agli stimoli dolorosi (iperalgesia), ipersensibilità a stimoli normalmente non dolorosi (allodinia), mutua associazione fra le CSS, presenza di disturbi psichici (almeno in un sottogruppo di pazienti).
La Sensibilizzazione Centrale
Per sensitization (sensibilizzazione) intendiamo un processo in cui lo stimolo necessario per generare una risposta diminuisce nel tempo, mentre l'ampiezza della risposta a un dato stimolo aumenta (Magerl et al, 1998). Quindi si tratta di una sorta d’ipersensibilità a stimoli dolorosi, di mancata assuefazione ai medesimi e in termini clinici a iperalgesia (risposta esagerata ad uno stimolo doloroso) e allodinia (dolore provocato da stimolo non doloroso). Fenomeni di CS sono stati dimostrati in tutte le CSS, quindi anche nell’emicrania, per la quale ci sono evidenze sempre più significative che la CS gioca un ruolo importante negli ultimi stadi dell’attacco acuto di emicrania e nello sviluppo delle forme croniche (Burstein et al. 2000). Un articolo pubblicato su Nature nel 1996 ipotizzò che i neuroni sensoriali meningei, come i nocicettori di altre parti del corpo, esibivano chemiosensibilità e sensibilizzazione (Strassman et al.).
La progressione della sensibilizzazione periferica verso i neuroni centrali del sistema trigeminovasculare potrebbe spiegare molti dei fenomeni clinici dell’emicrania. La Sensibilizzazione Periferica sarebbe provocata da fenomeni neuroinfiammatori sui nocicettori trigeminali durali e meningei, con il risultato di un abbassamento della soglia di attivazione dei medesimi e un aumento della risposta ai successivi stimoli. I trigger di questo processo sarebbero la cortical speading depression nell’emicrania con aura e/o una disfunzione autonomica con eccessiva attività parasimpatica in emicrania senza aura (Yarnitsly, 2003). Le raffiche di stimoli ripetitive in arrivo dai nocicettori innescherebbero l’ipereccitabilità dei neuroni di secondo ordine, quindi la CS del nucleo trigeminale caudale (TNC), il cui cambiamento di stato sarebbe probabilmente mediato anche qui dai recettori NMDA, da riduzione dei livelli di magnesio e da un aumento di calcio e glutammato (Silberstein, 2004). S’ipotizza che gli obiettivi vulnerabili per la sensibilizzazione periferica siano i n. sensoriali che forniscono i vasi sanguigni intracranici e le meningi (Moskowitz, 1988. I n. trigemino-vasculari di primo e secondo ordine sensibilizzati in seguito divengono più sensibili a stimoli meccanici innocui in precedenza, tipo lo strofinamento della pelle periorbitaria (allodinia cutanea). Ciò è causato dal fatto che il TNC riceve input convergenti oltre che da vasi sanguigni e meningi intracraniali (Woolf et al,1995; Magerl,1998). E’ per questi fenomeni di CS che durante gli attacchi molti emicranici evitano attività come lavarsi i capelli, barba, indossare occhiali o toccarsi il cuoio capelluto, in quanto stimolando la pelle intensificano il dolore. Clinicamente quindi la CS è caratterizzata da iperalgesia, allodinia, espansione dei campi recettivi (che ci può spiegare il dolore diffuso), prolungata scarica elettrofisiologica (che ci può spiegare la natura cronica del dolore) e da un dolore spiacevole post-stimolo (definito come bruciante, pulsante e parestesico) che dura più a lungo rispetto ai controlli dopo uno stimolo spiacevole. A causa del notevole ipereccitamento complessivo dei neuroni centrali, la CS ci può spiegare l’ipersensibilità a molti stimoli ambientali (rumore, tempo, stress) e chimici (es. pesticidi e farmaci). La CS tende ad autosostenersi senza ulteriori stimoli, a causa della neuroplasticità a lungo termine e probabilmente si accentua nella cronicità delle malattie nell’uomo.
Di fondamentale importanza per lo sviluppo della CS è anche il cosiddetto Sistema Antinocicettivo Discendente costituito da centri nervosi (PAG-RVM o Midollo Rostro-Ventro-Mediale) e fibre discendenti che attivate dallo stimolo doloroso agiscono sul corno dorsale con un controllo inibitorio analgesico. Tali meccanismi d’inibizione del dolore normalmente attenuano la CS. Queste vie discendenti dal sistema cortico-reticolare, locus coeruleus, ipotalamo, tronco cerebrale e interneuroni locali del midollo spinale in prevalenza utilizzano come neurotrasmettitori soprattutto serotonina, noradrenalina, ma anche GABA ed encefaline.
Un’esperienza oggettiva di dolore dopo che impatta con il sistema di rilevazione, trasduzione e processazione del messaggio diviene un’esperienza soggettiva, le cui caratteristiche dipendono da quelle del dolore (intensità e ripetitività), ma anche del sistema rilevante. La percezione dolorosa finale dipende dall'interazione fra il sistema di trasmissione nocicettivo e quello di modulazione antinocicettivo. Un dolore diviene sintomatico quando vi è squilibrio tra questi due sistemi, con prevalenza della nocicezione sull’anti-nocicezione. Di conseguenza la CS viene favorita sia dalla persistenza e dalla intensità degli stimoli dolorosi, che da una processazione del dolore disfunzionante. In tutte le CSS vi sono evidenze di CS, ma queste alterazioni di processazione del dolore sono secondarie a input dolorosi continui o rappresentano un meccanismo primario di malattia?
Nella processazione della componente emotiva degli stimoli dolorosi indubbia importanza hanno i centri nervosi del cosiddetto “core emotivo”, costituito principalmente da: amigdala, ippocampo, corteccia orbitofrontale e corteccia cingolata anteriore. Vi è evidenza che esercitano un effetto inibitorio sul circuito dell’amigdala (Kent et al., 2003). Questi sistemi neurali sono coinvolti nelle risposte agli stressors, in quanto costituiscono i fattori principali nella traduzione degli stimoli ambientali in risposte comportamentali e / o fisiologiche (Le Doux, 1996). Essi rappresentano i regolatori primari del cosiddetto adattamento allostatico, dove con il termine allostasi (da allos=cambiamento + stasis=stabilità), superamento del concetto di omeostasi, intendiamo la capacità dell’organismo di rispondere alle minacce in anticipo con un eccitamento al fine di mantenere un’ambiente interno stabile, quindi un cambiamento per mantenere l’omeostasi. La chiave di volta di questo modello è l'identificazione del cervello come mediatore primario di allostasi, cioè come principale punto di interfaccia tra un fattore di stress nel suo contesto fisico e sociale, e l’adattamento fisiologico e comportamentale dell’individuo a quel fattore di stress. Particolare importanza ricopre in tal senso l’amigdala, che“ rappresenta l’epicentro degli eventi coinvolti nella modulazione degli stati d’ansia, nell’animale come nell’uomo, con un ampio spettro di connessioni reciproche con le strutture corticali, limbiche, implicate nella risposta emozionale, cognitiva, autonomica ed endocrina allo stress. (Le Doux, 2000)”. Vi sono crescenti evidenze sperimentali (di neuroimaging e laboratorio) di disfunzionamento nel core emotivo, associati in particolare con disturbi psichici. Infatti studi di neuroimaging hanno evidenziato fenomeni d’iperattivazione dell'amigdala e dell’insula più frequentemente nel disturbo d'ansia sociale e nelle fobie specifiche, mentre nel PTSD è stato rilevata ipoattività della corteccia cingolata anteriore e nella prefrontale ventromediale (Etkin et al,2007).
Nel disturbo di personalità borderline sono state osservate risposte esagerate agli stimoli emozionali nell'amigdala e diminuite nella corteccia cingolata anteriore, mentre nel disturbo bipolare diversi studi di neuroimaging hanno riportato un aumento dei volumi dell'amigdala tra i pazienti rispetto ai sani. Viceversa il volume ACC sembra essere diminuito di volume (Foland et al, 2008).
Inoltre sono state riportate associazioni tra l'attivazione dell'amigdala e la regione polimorfica del gene trasportatore della serotonina (5-HTTLPR). (Munafò et al,2008). Uno stato d’iperattività dell’amigdala quindi appare sicuramente correlato con l’ansia, con gli stati di allerta, di snervante attesa nel dubbio di mettere in atto un cambiamento anticipatorio, allostatico, al fine di preservare l’omeostasi dell’organismo con tutte le implicazioni endocrine, autonomiche ed emozionali correlate. L'amigdala inoltre sta emergendo anche come un elemento importante della rete coinvolta nella processazione della componente emotivo-affettiva del dolore (Pedersen LH et al. 2007). Si pensa che essa sia un substrato fondamentale della relazione reciproca tra il dolore e disturbi come ansia. In un modello di dolore da artrite murina è stata dimostrata CS e plasticità sinaptica (Neugebauer et al., 2003) nel nucleo centrale dell'amigdala (CEA), il quale integra le informazioni correlate all’affettività provenienti dal circuito della paura-ansia con input puramente nocicettivi provenienti dalla via del dolore spino-parabrachio-amigdaloidea (Neugebaer et al, 2007). Una plasticità sinaptica correlata al dolore nel CEA è stato confermata anche in un modello di dolore neuropatico cronico (Ikeda et al, 2007 ).
Conclusioni
Essendo i centri del core emotivo interconnessi con vie ascendenti e discendenti nocicettive, si può ipotizzare che la presenza di disfunzionamenti a questo livello possa favorire risposte altrettanto anomale nella processazione del dolore. E ove tali risposte disfunzionanti si prolungassero nel tempo, esse potrebbero produrre un aumento eccessivo di quel carico allostatico alla lunga così logorante per la salute del nostro organismo a causa dei danni ormonali, autonomici e immunologici che esso produce. E in termini di mancata inibizione della CS, ciò potrebbe tendere a favorire l’amplificazione della stessa e in termini clinici la cronicizzazione del dolore. Un attacco emicranico oltre che essere favorito da triggers, è un trigger esso stesso, nel senso di stressor, quindi fautore di una risposta allostatica del S.N. Quando quest’ultima è disfunzionante appare verosimile che nel tempo possa provocare un’ipersensibilità o se volete una mancata assuefazione allo stressor stesso e quindi una ridotta antinocicettività, che sicuramente favorisce la cronicizzazione del dolore e l’aumento della disabilità del medesimo. Ciò potrebbe rappresentare l’anello di congiunzione fra la cronicizzazione del dolore e la presenza di alta comorbidità per disturbi emotivi. Ab origine generalmente esisterebbe sempre un primum movens doloroso periferico, sia che ci si riferisca ad emicrania, che a un trauma cranico, a un colpo di frusta, al colon irritabile etc.etc. Se però il sistema di processazione emotiva dell’evento doloroso è disfunzionante, ciò potrebbe produrre un’amplificazione, piuttosto che un’estinzione dell’evento stesso. Quando poi l’ampliamento dei campi recettivi sarebbe tale da portare alla diffusione del dolore oltre i suoi abituali territori d’innervazione, ciò finirebbe per favorire l’instaurarsi di fenomeni di diffusione estrema del dolore, dei quali le fibromialgie rappresentano l’esempio più emblematico. In conseguenza di tutto ciò appare probabile che la fibromialgia più che un dei tanti membri della famiglia delle CSS,rappresenti l’evoluzione estrema e cronicizzata di tante realtà dolorose periferiche.
Bibliografia
- Burstein R, Cutrer MF, Yarnitsky D. The development of cutaneous allodynia during a migraine attack: Clinical evidence for the sequential recruitment of spinal and supraspinal nociceptive neurons in migraine. Brain. 2000;123(Pt 8):1703-1709.
-De Tommaso M, Federici A, Serpino C, Vecchio E, Franco G, Sardaro M, Delussi M, Livrea P. Clinical features of headache patients with fibromyalgia comorbidity. J Headache Pain. 2011 Dec;12(6):629-38.
-Etkin A, Wager TD. Functional neuroimaging of anxiety: a meta-analysis of emotional processing in PTSD, social anxiety disorder, and specific phobia. AmJPsychiatry. 2007;164:147688.
- Foland LC, Altshuler LL, Sugar CA et al. Increased volume of the amygdala and hippocampus in bipolar patients treated with lithium. Neuroreport. 2008 January 22; 19(2): 221–224.
Hudson JI, Pope HG Jr. Fibromyalgia and psychopathology: is fibromyalgia a form of “affective spectrum disorder”? J Rheumatol Suppl 1989;19:15-22.
- Ifergane G, Buskila D, Simiseshvely N, Zeev K, Cohen H. Prevalence of fibromyalgia syndrome in migraine patients. Cephalalgia. 2005;26:451–456. doi: 10.1111/j.1468-2982.2005.01060.
- Ikeda R, Takahashi Y, Inoue K, Kato F. NMDA receptor-independent synaptic plasticity in the central amygdala in the rat model of neuropathic pain. Pain. 2007;127:161–172
- Kent JM, Rauch SL. Neurocircuitry of anxiety disorders.Curr Psychiatry Rep. 2003 Aug;5(4):266-73.
-Kindler LL, Bennett RM, Jones KD.Central sensitivity syndromes: mounting pathophysiologic evidence to link fibromyalgia with other common chronic pain disorders. Pain Manag Nurs. 2011 Mar;12(1):15-24.
- LeDoux, J. E. (1996). The Emotional Brain, Simon and Schuster, New York.
- LeDoux, J. E. (2000). Emotion circuits in the brain. Annu. Rev. Neurosci. 23:155–184.
- Mager l W,Wilk SH, Treede RD. Secondary hyperalgesia and perceptual wind-up following intradermal injection of capsaicin in humans. Pain. 1998;74:257-268.
- Moskowitz MA, Henrikson BM, Markowitz S, et al. Intra- and extracraniovascular nociceptive mechanisms and the pathogenesis of pain. In: Olesen J, Edvinsson L, Basic Mechanisms of Headache. Amsterdam: Elsevier; 1988:429-437.
- Munafò MR, Brown SM,Hariri AR. Serotonin Transporter(5-HTTLPR) Genotype and Amygdala Activation: A Meta-Analysis. Biol Psychiatry. 2008 May 1; 63(9): 852–857.
- Neugebauer V, Li W, Bird GC, Bhave G, Gereau RW. Synaptic plasticity in the amygdala in a model of arthritic pain: differential roles of metabotropic glutamate receptors 1 and 5. J
Neurosci. 2003;23:52–63.
- Neugebauer V, Han JS, Adwanikar H, Fu Y, Ji G. Techniques for assessing knee joint pain in arthritis. Mol Pain. 2007
- Pedersen LH, Scheel-Kruger J, Blackburn-Munro G. Amygdala GABA-A receptor involvement in mediating sensory-discriminative and affective-motivational pain responses in a rat model of peripheral nerve injury. Pain. 2007;127
- Peres MF, Young WB, Kaup AO, Zukerman E, Silberstein SD. Fibromyalgia is common in patientswith transformed migraine. Neurology. 2001;57:1326–1328.
- Silberstein S, Dodick D. Central Sensitization Theory of Migraine: Clinical Implications. Headache 2006.
- Silberstein SD. Migraine pathophysiology and its clinical implications. Cephalalgia. 2004;24(suppl 2):2-7.
- Strassman AM, Raymond SA, Burstein R. Sensitization of meningeal sensory neurons and the origin of headaches. Nature. 1996;384:560-564.
- Tietjen GE, Brandes JL, Peterlin BL, et al. Allodynia in migraine: association with comorbid pain conditions. Headache. 2009;49(9):1333–1344.
- Yarnitsky D, Goor-Aryeh I, RE. Reorganization of central terminals of myelinated primary afferents in the rat dorsal horn following peripheral axotomy. JComp Neurol. 1995;360:121-134.Bajwa ZH, et al. 2003 Wolff Award: Possible parasympathetic contributions to peripheral and central sensitization during migraine. Headache. 2003;43:704-714.
-Yunus MB. Fibromyalgia and Overlapping Disorders: The Unifying Concept of Central Sensitivity Syndromes. Semin Arthritis Rheum. 2007 Jun;36(6):339-56.
-Yunus MB. Central sensitivity syndromes: a new paradigm and group nosology for fibromyalgia and overlapping conditions, and the related issue of disease versus illness. Semin Arthritis Rheum. 2008 Jun;37(6):339-52.
- Yunus MB, Masi AT, Calabro JJ, Miller KA, Feigenbaum SL.Primary fibromyalgia (fibrositis): clinical study of 50 patients with matched normal controls. Semin Arthritis Rheum 1981;11:151-71.
-Yunus MB. Central sensitivity syndromes: a unified concept for fibromyalgia and other similar maladies. J Indian Rheumatism Assoc 2000;8:27-33.
- Woolf CJ, Shortland P, Reynolds M, Ridings J,Doubell T, Coggeshall